
Responsable d'équipe
Alexandre Benani
Téléphone : 03 80 68 16 27
Email : alexandre.benani@u-bourgogne.fr


Responsable d'équipe
Téléphone : 03 80 68 16 27
Email : alexandre.benani@u-bourgogne.fr

Responsable adjointe d'équipe
Téléphone : 03 80 68 16 77
chercheurs
P. Andreoletti, M. Cherkaoui-Malki, F. Datiche, L. Merle, S. Savary, D. Trompier, A. Véjux.
IngÉnieurs et techniciens
N. Bancod, V. Gigot, C. Gondcaille, L. Leret, F. Liénard, H. Mottous, E. Nedelec, B. Patris, V. Pires, E. Vasseur.
doctorants
M. Perrignon-Sommet, J. Salvi, V. Schneider.
stagiaires
N. Aglagal, S. Buiret, A. Mercier, M. Teixeira.
Mots-clés : Neuroendocrinologie, Hypothalamus, Plasticité synaptique, Système à mélanocortine, Prise alimentaire, Recherche sur les obésités, Prédisposition à l’obésité, Epigénétique.
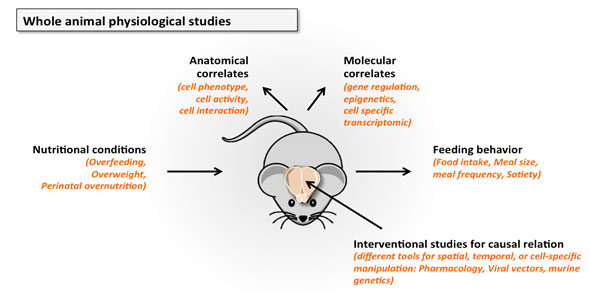
Thématique : A travers des études moléculaires et histologiques chez la souris et grâce à des manipulations génétiques et pharmacologiques, nous étudions les bases neurobiologiques du comportement alimentaire et nous cherchons à identifier des molécules impliquées dans le contrôle de l’homéostasie énergétique.
L'équipe en détail Ouvrir tous les onglets
On connait peu de choses sur la capacité du circuit à mélanocortine à modifier son organisation synaptique dans le cerveau mature, si ce n’est qu’un réarrangement réversible se produit rapidement après des variations hormonales et métaboliques et que cette capacité semble altérée lors de l’obésité.
Projet ANR NCAM2 : « Neural control of appetite and metabolism by neural cell adhesion molecule » (ANR- 13-JSV1-0003-01).
Prix de recherche de l’Institut Benjamin Delessert Prix de recherche de l’Institut Benjamin Delessert
Prix de recherche de la Société de Nutrition,
« Bonus Qualité Recherche » Université de Bourgogne-Franche Comté
Crédit incitatif INRAE « métaprogramme SweetLipKid »
Schneider, N. Y., Chaudy, S., Epstein, A. L., Viollet, C., Benani, A., Pénicaud, L., Grosmaître, X., Datiche, F. and Gascuel, J. (2019). Centrifugal projections to the main olfactory bulb revealed by trans-synaptic retrograde tracing in mice. J. Comp. Neurol. Doi: 10.1002/cne.24846.
Jehl, F., Désert, C., Klopp, C., Brenet, M., Rau, A., Leroux, S., Boutin, M., Lagoutte, L., Muret, K., Blum, Y., Esquerré, D., Gourichon, D., Burlot, T., Collin, A., Pitel, F., Benani, A., Zerjal, T. and Lagarrigue, S. (2019). Chicken adaptive response to low energy diet: main role of the hypothalamic lipid metabolism revealed by a phenotypic and multi-tissue transcriptomic approach. BMG Genomics 20(1): 1033.
Prévost, G., Arabo, A., Le Solliec, M.-A., Bons, J., Picot, M., Maucotel, J., Berrahmoune, H., El Mehdi, M., Cherifi, S., Benani, A., Nédélec, E., Coëffier, M., Leprince, J., Nordqvist, A., Brunel, V., Déchelotte, P., Lefebvre, H., Anouar, Y. and Chartrel, N. (2019). Neuropeptide 26RFa (QRFP) is a key regulator of glucose homeostasis and its activity is markedly altered in obese/hyperglycemic mice. Am. J. Physiol.-Endocrinol. Metab. 317(1): E147-E157.
Prévost, G., Picot, M., Le Solliec, M.-A., Arabo, A., Berrahmoune, H., El Mehdi, M., Cherifi, S., Benani, A., Nédélec, E., Gobet, F., Brunel, V., Leprince, J., Lefebvre, H., Anouar, Y. and Chartrel, N. (2019). The neuropeptide 26RFa in the human gut and pancreas: potential involvement in glucose homeostasis. Endocr Connect 8(7): 941-951.
Brenachot, X., Nédélec, E., Ben Fradj, S., Boudry, G., Douard, V., Laderrière, A., Lemoine, A., Liénard, F., Nuzzaci, D., Pénicaud, L., Rigault, C. and Benani, A. (2018). Lack of hypothalamus polysialylation inducibility correlates with maladaptive eating behaviors and predisposition to obesity. Front. Nutr. 5: 125.
Brenachot, X., Gautier, T., Nédélec, E., Deckert, V., Laderrière, A., Nuzzaci, D., Rigault, C., Lemoine, A., Pénicaud, L., Lagrost, L. and Benani, A. (2017). Brain control of plasma cholesterol involves polysialic acid molecules in the hypothalamus. Front. Neurosci. 11: 245.





offres emplois - stages - thèses